Laboratorio del corso di Biochimica del Metabolismo
Corso di Laurea in Biotecnologie
Produzione di una Proteina Ricombinante
La spettrofotometria
Le molecole di interesse biologico possono assorbire radiazioni in un ampio intervallo spettrale. Le regioni dello spettro elettromagnetico (fig 1) usate nelle tecniche descritte comprendono le radiazioni ultraviolette (UV) e visibili (VIS) cioè da 180 a 800 nm circa.
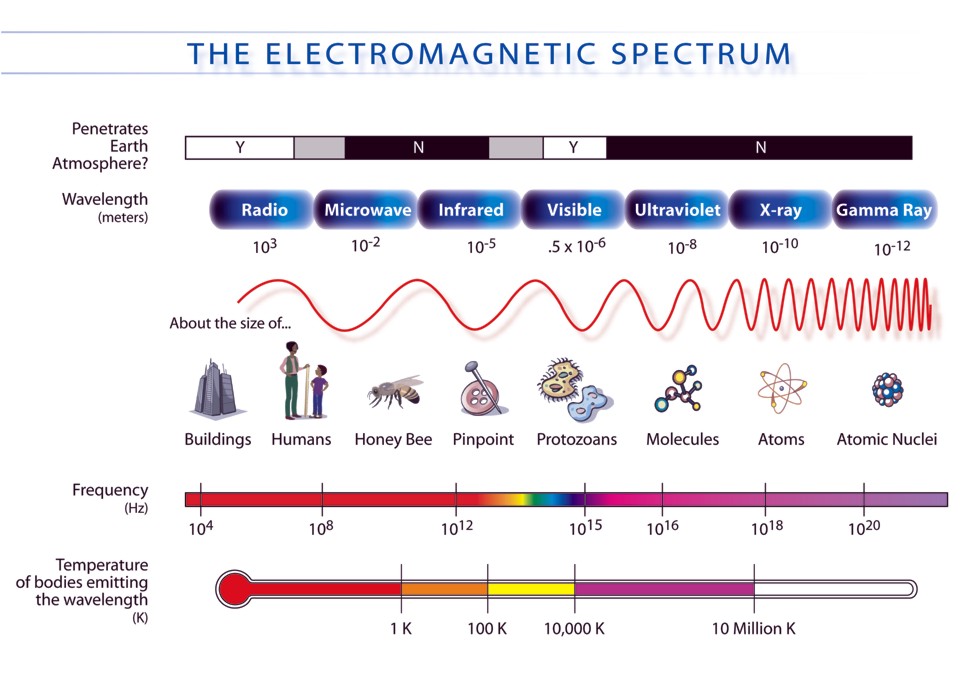
Fig. 1: Spettro elettromagnetico
Informazioni utili
I principi dell' interazione fra radiazioni e molecole possono essere spiegati mediante la curva di energia potenziale in funzione della distanza interatomica per il livello energetico elettronico più basso ossia lo stato fondamentale (fig. 2).
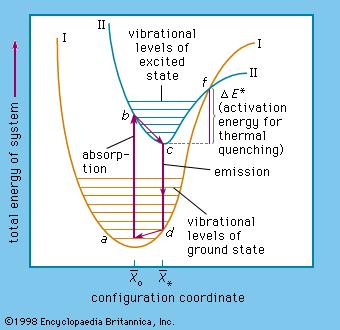
Fig. 2 : Diagramma dei livelli energetici che mostrano lo stato fondamentale e lo stato eccitato
La luce nella regione UV-VIS ha energia sufficiente per eccitare gli elettroni di valenza delle molecole, in altre parole gli elettroni passano dal livello elettronico più basso (chiamato stato fondamentale) ad uno stato elettronico eccitato che si trova a un livello di energia più alto e che e' descritto da una curva simile a quella dello stato fondamentale.
Per ognuno dei livelli energetici elettronici ci sono una serie di stati vibro-rotazionali (indicati dalle linee orizzontali). Tutti i livelli di energia sono quantizzati e le transizioni elettroniche tra di essi avvengono solo se l'energia assorbita e' pari alla DE fra i livelli stessi. Quindi questo valore determina la l della radiazione assorbita. In altre parole la transizione fra lo stato fondamentale (E) e lo stato eccitato (E1) ha un'alta probabilità di avvenire se l ' energia del fotone corrisponde a E1 - E cioè all'energia necessaria a far passare l' elettrone da E a E1.
L'energia del fotone e':
DE = h c / l , DE = E1- E
dove:
h = costante di Planck
c = velocita' della luce
l = lunghezza d'onda della radiazione
Secondo questa equazione piccoli valori nella differenza di energia fra i livelli energetici della molecola corrispondono a l elevati.
Risulta evidente che le proprietà di assorbimento della luce da parte delle molecole dipende dalla loro struttura cioè dagli atomi, dai gruppi funzionali e dal tipo di legami presenti. Ad esempio le proteine e gli acidi nucleici, data la loro struttura molecolare, non assorbono in modo significativo nella regione visibile a meno che non contengano gruppi prostetici (ad es. l'eme nell'emoglobina), che conferiscono particolari proprietà di assorbimento. Proteine e acidi nucleici assorbono nell' UV: le proteine assorbono a 220 nm per la presenza del legame amminico e a 280 nm per la presenza di amminoacidi con sistemi aromatici (es: Phe, Tyr e Trp); invece il DNA assorbe a 260 nm per la presenza di sistemi aromatici nelle basi azotate.
Lo spettro di assorbimento è quindi un elemento di identificazione di una molecola e si ottiene misurando l'intensità della luce assorbita in funzione della lunghezza d'onda. I dati caratterizzanti sono le lunghezze d'onda a cui l'assorbimento presenta un massimo.
Nella figura 3 sono riportati gli spettri di assorbimento della emoglobina ossigenata e deossigenata: i cambiamenti a livello della struttura molecolare si riflettono in un cambiamento dello spettro di assorbimento.
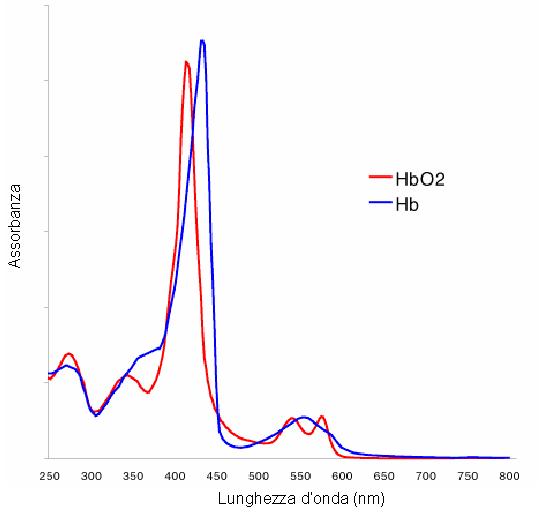
Fig 3: spettro di assorbimento dell’emoglobina nella forma ossigenata e deossigenata
La grandezza riportata sull'asse delle ordinate dà una misura di quanto una radiazione venga assorbita ed è detta assorbanza.
L' assorbanza dipende dall' intensita' della radiazione che colpisce il campione (I0) e da quella della radiazione che ha attraversato il campione ( I), secondo la relazione :
A= log10 I / I0
dove:
Il rapporto I /I0 = T, trasmittanza
A e T sono quindi in relazione fra loro: A = - log 10 T
La trasmittanza puo'assumere un valore compreso fra 0 e 1.
Infatti T = 0 se I = 0 , cioe' l'intensità della radiazione che ha attraversato il campione e' zero perchè è stata totalmente assorbita e in questo caso A=¥ .
T = 1 se I = I0, cioè l'intensità della radiazione che ha attraversato il campione e' eguale a quella incidente perchè non è stata assorbita e in questo caso A=0.
La relazione più utile nella tecnica spettrofotometrica è quella che mette in relazione l'A con la concentrazione della soluzione in esame ed e' nota come legge di Lambert-Beer:
A = ebc (1) 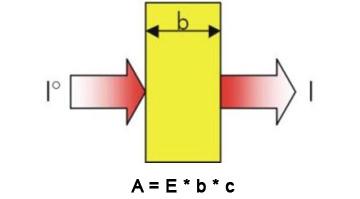
dove :
e = costante che dipende dalla l e dalla sostanza ed e' chiamato coefficiente di estinzione e le sue dimensioni dipendono dalle unità in cui e' espressa la concentrazione. Se la concentrazione e' espressa in molarità e la cuvetta usata e' da 1 cm, e ha le dimensioni di M-1 cm-1.
b = lunghezza del cammino ottico attraverso il campione, dipende dalla cuvetta usata ed e' espressa in cm.
c = concentrazione espressa nell' unità di misura opportuna.
A essendo un logaritmo e' una grandezza senza dimensioni.
Una volta determinato il coefficiente di estinzione di una sostanza ad una determinata lunghezza d'onda misurando l'assorbanza di una soluzione ottenuta per pesata, la concentrazione di ogni altra soluzione di quella sostanza può essere calcolata con una semplice misura di assorbanza e utilizzando la relazione (1).
L'assorbanza è una grandezza additiva nel senso che al valore di A misurato contribuiscono tutti i componenti il sistema che assorbono a quella lunghezza d' onda (solvente, cuvetta, etc.). Per questo per le misure di A si usa un sistema di riferimento (blank) costituito dai componenti il sistema tranne la sostanza di interesse. L' assorbanza del blank va quindi sottratta a quella del campione per avere l'assorbanza netta dovuta alla sostanza.
Quindi la dipendenza dell' A dalla lunghezza d' onda, cioè lo spettro di assorbimento, e il valore di e a una lunghezza d' onda sono parametri che caratterizzano univocamente una particolare sostanza e che possono essere usati il primo per l'identificazione e il secondo per la quantificazione.